前言
當代醫學的發展史中,19世紀是微生物醫學的黃金時代,科學家透過發現微生物、培養微生物並闡明其意義,奠定現今微生物學知識基礎。包括透過顯微鏡發現微生物的雷文霍克 (Antonie van Leeuwenhoek)、提出「柯霍式法則」建立微生物和疾病因果關係的柯霍 (Robert Koch) 以及闡明微生物意義、改良預防接種並發明巴氏消毒法的巴斯德 (Louis Pasteur)。早期研究微生物以致病菌為主,微生物學常被歸類在感染醫學的範疇,自佛萊明 (Alexander Fleming) 20世紀發現盤尼西林後,近百年來人類發展出各種抗生素,治療感染症病患拯救許多性命。然而,在根除微生物的治療策略下,有時會忽略了微生物與宿主共存共榮的可能性。
事實上,人體內共生的細菌多達數十兆,比人類本身的細胞數還多,而腸道菌所含有的基因總數,更是人類基因的100倍。因此,人類微生物叢 (human microbiota) 可說是貢獻了人類的第二基因體 (second genome),甚至被視為一個過去被遺忘的重要「器官」。這些複雜的微生物叢包括細菌、黴菌與病毒,廣泛存在於人類的皮膚、呼吸道、腸道、泌尿道、生殖道等器官。自21世紀起,科學家發現在遍佈人體全身的微生物叢中,腸道菌叢 (gut microbiota) 與宿主的交互作用,可直接或間接地影響宿主的免疫、代謝與神經傳遞功能,而人體微生物叢 (human microbiota) 的相關研究,讓過去許多不明病因的人類慢性與退化性疾病,開啟了一條全新的解方尋求之路。腸道菌對人體健康與疾病的影響,主要可以分成三個面向討論,分別為免疫、代謝與腸腦軸 (gut-brain axis)。
免疫系統
免疫系統是生物體所建立的防禦機制,主要針對體內的異常物質進行排斥反應,包括各種微生物、寄生蟲、過敏原與腫瘤細胞等,目的為抵禦外來物質對生物體所產生的危害。若將人體比喻成一座城市,免疫系統就像明察秋毫的司法體系,對付壞人同時也保護好人, 如幼年時期開始面對各種環境刺激的訓練,教導免疫系統辨認敵我,一方面對病原進行清除反應 (immune clearance),控制感染與腫瘤疾病,一方面與和平共存的環境抗原 (如共生微生物、過敏原) 建立免疫容忍性 (immune tolerance),避免產生過度反應導致過敏與自體免疫疾病。
腸道微生物叢存在於表面積高達兩座網球場大的消化道粘膜上,與粘膜下腸淋巴組織 (gut-associated lymphoid tissue, GALT) 近在咫尺,是訓練人體免疫防禦系統的重要場域。腸道菌叢是否能維持良好狀態,影響宿主的免疫系統的正常發展,攸關免疫系統對抗感染與腫瘤疾病的能力,也可能影響自體免疫疾病的發生。近年美國國衛院研究人員發現,相對於實驗鼠,野鼠的腸道菌能刺激宿主產生較佳的免疫力以對抗流感病毒與大腸腫瘤。台大研究團隊也在動物實驗發現,腸道菌組成對於免疫調控的機制,會影響宿主清除B肝病毒的能力,是B肝病毒急性感染後是否成為帶原者的重要因素。
日本慶應大學Kenya Honda團隊更近一步證實,Th1輔助細胞、Th17輔助細胞、調節T細胞 (Treg) 與細胞毒性T細胞 (cytotoxic T cell) 等後天免應系統 (adaptive immunity) 的成熟與特定腸道菌叢的刺激有關,並發現相關機制能影響發炎性腸炎 (inflammatory bowel disease) 的嚴重度以及免疫系統對抗腫瘤的能力,甚至影響免疫療法 (immunotherapy) 治療癌症的效果。然而,由於腸道菌組成與免疫細胞的交互作用相當複雜,人體各種免疫細胞成熟與分化過程中,腸道微生物叢所扮演的調控角色仍未完全清楚,未來若能闡明其中關鍵的分子機制,將可為免疫治療方法帶來新的契機。
代謝系統
人體的代謝系統是維持生命正常運作的生化反應集合,涵蓋各種分解與合成的有機反應、能量使用和儲存方式,及代謝過程所產生的化學分子,在體內所產生的生物反應、利用與解毒過程。如果將免疫系統比喻作司法體系,那麼代謝系統則像金融體系,掌管能量儲存與消耗。一般來說,人體的代謝能力會隨著生命週期有所變化,嬰兒、青少年、成年、老年與孕期的代謝能力皆有所差異,主要是受荷爾蒙的調控以應對發育與環境適應需求。即使處於相同的生命階段,不同個體的代謝能力仍具明顯差異。近年不少研究顯示,代謝體質的差異可能來自腸道微生物叢與其代謝物對宿主的調節作用,並可能是導致肥胖、糖尿病、心血管疾病、脂肪肝等疾病的重要因素 (圖一)。
腸道菌研究之父,美國聖路易斯華盛頓大學Jeffrey Gordon率先發現,在相同基因背景與飲食的狀態下,腸道菌為肥胖與營養不良的重要病因。而腸道菌代謝膳食纖維所產生的短鏈脂肪酸 (short chain fatty acids, SCFAs) 對宿主細胞G-protein coupled receptor 41與G-protein coupled receptor 43的作用,以及膽酸與farnesoid X receptor和Takeda G-protein coupled receptor 作用所產生的下游訊號,已被證實是腸道菌調節宿主能量消耗與脂肪形成的重要途徑。相關研究說明了臨床上具有相同基因背景的病患,可有不同的代謝表徵,甚至相似飲食習慣的人,也會有易胖與易瘦體質的差異。
除了短鏈脂肪酸與膽酸之外,腸道菌也會利用飲食中許多蛋白質與脂質相關的營養素,產生各種具有生物活性的化學產物,調控宿主的生理代謝功能。比如說腸道厭氧菌能利用食物中未消化的膽鹼 (choline) 與肉鹼 (carnitine) 產生三甲胺 (trimethylamine, TMA),進入肝臟被黃素單氧化酶 (flavin monooxygenase, FMO) 作用,在人體內形成氧化三甲胺 (trimethylamine N-oxide, TMAO),進入循環系統後由腎臟排出。氧化三甲胺目前已證實是導致粥狀動脈硬化與血管栓塞的獨立因子,對心血管疾病所帶來的風險存在劑量依賴效應,可望成為未來監測心血管疾病的重要標的。
此外,部分必須透過腸道菌才能產生的小分子代謝物,陸續被發現其潛在影響宿主血糖與脂肪代謝的生物活性,如吲哚衍伸物 (indole derivatives)、咪唑-4-酮-5-丙酸 (imidazole propionate)、苯乙酸 (phenylacetic acid) 等,分別為色氨酸 (tryptophan)、組氨酸 (histidine) 與苯丙氨酸(phenylalanine) 的腸道菌代謝產物 (表一)。然而,由於目前相關的微生物代謝途徑仍未完全明朗,究竟是哪些關鍵菌種扮演影響宿主生理機制的重要角色,以及相關基因產物導致疾病相關的代謝反應,未來仍需進一步釐清。
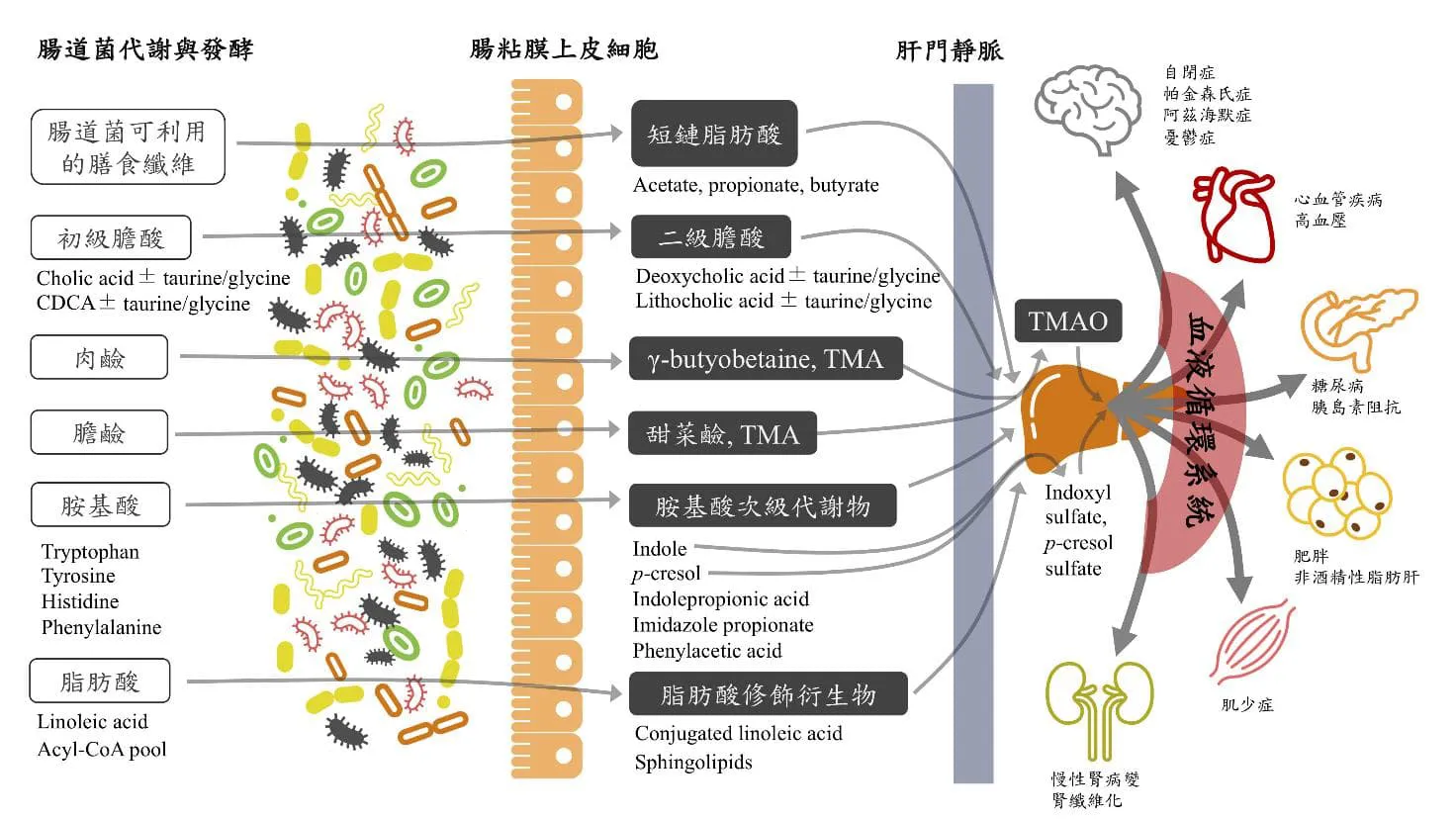
圖一 腸道菌代謝產物由腸腔進入體循環 (Gut-systemic axis) 調控全身病生理狀態。(adapted from Wu WK et al. Rapid Commun Mass Spectrom 2020)
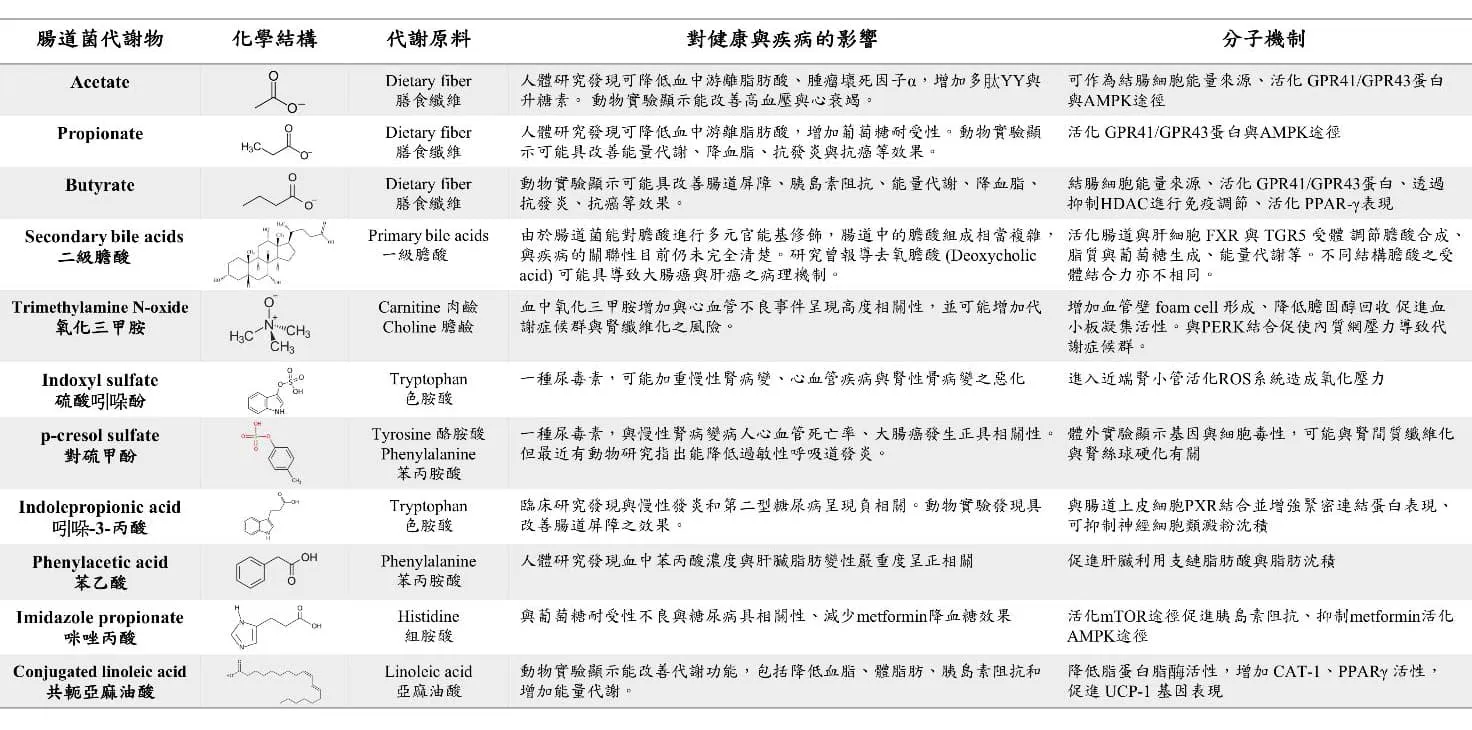
表一 目前已知具生物活性之小分子腸道代謝物 (adapted from Wu WK et al. Rapid Commun Mass Spectrom 2020)
腸-菌叢-腦軸線 (gut-microbiota-brain axis)
除了調節人體的免疫與代謝功能外,腸道微生物叢也能影響中樞神經系統 (central nervous system, CNS) 功能,包括發育性 (如自閉症)、退化性 (如帕金森氏症、阿茲海默症)、發炎性 (如癲癇) 與情感性 (如焦慮症、憂鬱症) 神經疾病,甚至食慾與攝食等行為表現,都被發現與腸道菌的組成與功能有關,且因果關係與部分機制已被研究證實。事實上,人體的腸神經系統 (enteric nervous system, ENS) 擁有神經元數目與網絡複雜度僅次於大腦,除了透過迷走神經 (vagus nerve) 與大腦進行訊息溝通外,也能透過腸道內分泌細胞 (enteroendocrine cells) 所分泌的神經傳導物質 (neurotransmitters) 獨立作業,故ENS有第二個大腦之稱。流病研究發現,部分退化性神經疾病與精神疾患,如帕金森氏症、阿茲海默症與焦慮症,常伴隨有慢性便秘與腹瀉等腸道相關共病症,支持腸道與大腦之間的緊密連結關係。
目前科學界普遍認為,在腸-菌叢-腦軸線 (gut-microbiota-brain axis) 中,腸道與大腦溝通主要透過兩條途徑:一條是來自腸道菌代謝物、腸道神經性賀爾蒙、腸道粘膜下免疫反應與ENS交互作用所產生的下游訊號,透過迷走神經與大腦進行訊息回饋。另一條則是腸道菌代謝物與神經傳遞物質進入血液循環系統,通過血腦屏障 (blood brain barrier) 進入中樞神經系統與腦細胞進行作用。如人體內超過 90% 的血清素 (serotonin, 5HT),是由腸道類腸嗜鉻細胞 (enterochromaffin-like cell, ECC) 代謝食物的色氨酸所形成,透過迷走神經與大腦進行訊息傳遞,而近期研究發現,ECC分泌血清素的功能需仰賴腸道菌的刺激,顯示腸道菌叢在腸腦軸 (gut-brain axis) 所扮演的調控角色。此外,人體腸道菌叢本身亦能在腸腔內製造多種神經傳導物質,包括多巴胺 (dopamine)、 γ-aminobutyric acid (GABA)、血清素 (serotonin)、正腎上腺素(norepinephrine) 等,然而這些物質是否能有效傳遞至ENS與CNS並發揮作用仍有待進一步研究證實。總結來說,大腦與腸道兩種器官雖在解剖位置上天差地遠,但兩者之間確實存在密不可分的關係,而腸道微生物叢在腸道與大腦的溝通聯繫中,扮演舉足輕重的角色。腸道對大腦來說,有如運籌帷幄之中,決勝千里之外,未來若能闡明更多腸-菌叢-腦軸線的病生理機制,將可望達到腦病腸治的目標。
推薦閱讀
- Allaband C et al: Microbiome 101: Studying, Analyzing, and Interpreting Gut Microbiome Data for Clinicians. Clin Gastroenterol Hepatol 2019; 17:218-30.
- Aron-Wisnewsky et al: Nonalcoholic Fatty Liver Disease: Modulating Gut Microbiota to Improve Severity? Gastroenterology 2020; 158:1881-98.
- Cani PD. Human gut microbiome: hopes, threats and promises. Gut 2018; 67:1716-25.
- Chou HH et al: Age-related immune clearance of hepatitis B virus infection requires the establishment of gut microbiota. Proc Natl Acad Sci 2015; 112:2175-80.
- Chua HH et al: Intestinal dysbiosis featuring abundance of Ruminococcus gnavus associates with allergic diseases in infants. Gastroenterology 2018; 154:154-67.
- Durack J et al: The gut microbiome: Relationships with disease and opportunities for therapy. J Exp Med 2019; 216:20-40.
- Fan Y et al: Gut microbiota in human metabolic health and disease. Nat Rev Microbiol 2021; 19:55-71.
- Gilbert JA et al: Microbiome-wide association studies link dynamic microbial consortia to disease. Nature 2016; 535:94-103.
- Knight R et al: Best practices for analysing microbiomes. Nat Rev Microbiol 2018; 16:410-22.




